La
Willémite
La
Willémite, silicate de zinc,
Zn2SiO4, est la forme cristalline produite
par les glaçures riches en oxyde de
zinc. Dans les glaçures
macro-cristallines au zinc, les aiguilles
de Willémites rayonnent à
partir d'un germe central et tendent
à former des sphérolites qui
peuvent ressembler à des fleurs
telles que les
pensées…
La
Willémite est composée
d'assemblages tétraédriques
associant le zinc et le silicium à
l'oxygène selon trois sites
cristallographiques distincts : les deux
sites du zinc avec de
légères différences,
Zn1 et Zn2, Zn1 avec la distance Zn-O =
1.950 Å et Zn2 avec la distance Zn-O
= 1.961 Å, et le site du silicium Si
avec la distance Si-O = 1.635 Å.
-
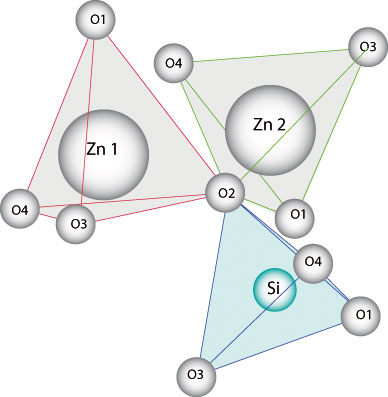
-
- Sites
tétraédriques du cristal de
Willémite (Zn2SiO4)
- Les
oxygènes ne sont pas
représentés à
l'échelle pour faciliter la lecture
de ce schéma
-
-
Les
substitutions
cationiques
La
coloration des cristaux de
Willémite formés lors des
paliers de croissance cristalline est due
à des substitutions cationiques au
sein de l'édifice cristallin.
L'ajout de petites quantités de
composés de métaux de
transition dans la glaçure permet
ce mécanisme de coloration.
-
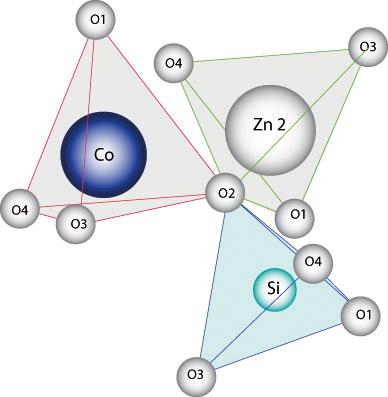
-
- Cation
du site tétraédrique Zn1
substitué par un cation de
Cobalt
- (Zn
2-x Co x SiO4) - Les cristaux se colorent
en bleu
-
-
Les
principaux cations des métaux de
transition permettant la coloration des
cristaux de Willémite par
substitution du zinc sont les suivants
:
-
Le manganèse
-
Le fer
-
Le cobalt
-
Le nickel
-
Le cuivre
|
|
RI
: 0.66 Å
|
RI
: 0.64 Å
|
RI
: 0.58 Å
|
RI
: 0.55 Å
|
RI
: 0.57 Å
|
RI
: 0.60 Å
|
Cations de métaux de transition
comparés au zinc, - représentés
selon leur rayon ionique RI en coordinence
IV
(tétraédrique)
-
-
-
Le
Nickel, le Cobalt et le Cuivre sont ceux
dont le rayon ionique (RI) est
inférieur à celui du
zinc.
En
présence de cations
différents, les substitutions se
feront selon des critères
d'affinité tendant vers
l'équilibre le plus
stable.
Les
règles de
Goldschmidt
(source
Wikipédia)

Victor
Goldschmidt
--(1888-1947)
Les
règles de Goldschmidt sont les
règles empiriques introduites
par Victor Goldschmidt en 1925-1926 pour
préciser les substitutions d'ions
qui peuvent se produire dans un
édifice cristallin. Elles reposent
sur le principe qui veut que l'ion
préférentiellement
incorporé dans une structure est
celui qui confère la plus grande
stabilité.
Première
règle : Pour que deux ions
puissent se remplacer l'un l'autre dans un
cristal, leurs rayons ioniques ne doivent
par différer de plus de 15 %. De 15
% à 30 %, la substitution peut se
faire mais elle est partielle.
Deuxième
règle : Les ions dont les
charges diffèrent d'une
unité, se substituent facilement
s'il y a un couple de remplacement pour
assurer l'équilibre
électrique (ex. Ca2+, Al3+ versus
Na+ Si4+). Si la différence de
charge est supérieure à une
unité, la substitution est plus
difficile.
Troisième
règle : Quand deux ions peuvent
occuper la même position, l'ion dont
la force de liaison est la plus importante
forme une liaison plus forte avec les
anions environnants.
Quatrième
règle : Introduite par Ringwood
en 1955, la quatrième règle
affirme que la substitution peut
être difficile même si les
critères de rayon ionique et charge
sont satisfaits, mais que les ions en
concurrence ont des
électronégativités
différentes et forment des liaisons
avec un caractère ionique
différent.
Deux
cations peuvent se substituer l'un
à l'autre si le plus grand
n'excède pas en taille 15% du plus
petit. A charge égale, c'est le
plus petit qui est
préférentiellement
intégré. A taille
égale, c'est le plus
chargé.
Exemple
: en présence de fer et de
cobalt, la substitution du zinc concernera
essentiellement le cobalt, le fer restera
dans la glaçure de fond. Car
à charge égale (2+) c'est le
plus petit qui est
préférentiellement
intégré (Rayon ionique du
cobalt est de 0.58 Å, contre 0.64
Å pour le fer et 0.60 Å pour
le zinc).
Éléments
Colorants
:
|
- Rayons
ioniques " RI "
- en
coordinence
4
- dans
le
cristal
- (d'après
Shannon)
|
- Force
de
liaison
- Z/RI
|
- Électronégativité
- De
Pauling
|
- Zinc
- Zn2+
|
0.60
Å
|
3.330
|
1.65
|
- Manganèse
- Mn2+
|
0.66
Å
|
3.030
|
1.55
|
- Fer
- Fe2+
|
0.64
Å
|
3.125
|
1.83
|
- Nickel
- Ni2+
|
0.55
Å
|
3.636
|
1.91
|
- Cobalt
- Co2+
|
0.58
Å
|
3.448
|
1.88
|
- Cuivre
- Cu2+
|
0.57
Å
|
3.508
|
1.90
|
La
substitution d'un cation de zinc (Zn2+)
par le cation d'un élément
de transition a rayon ionique très
proche tel que Co2+ (Cobalt),Ni2+ (Nickel)
ou Cu+2 (Cuivre) va permettre de colorer
les aiguilles cristallines des
sphérolites de
Willémite.
Dans
une glaçure cristalline au zinc
contenant du manganèse, la
substitution sera possible
(différence < à 15% par
rapport au zinc), idem avec du fer (+ 12%)
ou du nickel (-6.7 %).
On
pourra ainsi obtenir des glaçures
avec des cristaux colorés selon
l'élément ajouté.
C'est l'effet de la première
règle de
Goldschmidt.
Mais
si nous mettons plusieurs oxydes en
concurrence tels que le manganèse
et le nickel dans une glaçure
cristalline au zinc, les deux cations
peuvent occuper la place du zinc si on ne
considère que leur rayon ionique.
Par contre le nickel a une force de
liaison supérieure à celle
du manganèse, c'est donc le nickel
qui remplacera
préférentiellement le zinc
dans le réseau de willémite,
laissant le manganèse colorer le
fond de la glaçure. C'est l'effet
de la troisième règle de
Goldschmidt.
Liens
:
http://www.knowledgedoor.com/2/elements_handbook/silicon.html
http://webmineral.com/data/Willemite.shtml
-
Denis
Caraty / Mars 2013